ESTRUCTURA DEL ÁTOMO
Todos los cuerpos
están constituidos por partículas muy pequeñas, llamadas átomos. Por lo tanto, toda
substancia de nuestro planeta, viva o inerte, está formada de dichas
partículas. El átomo más pequeño es el del elemento hidrógeno, que se puede
asimilar a una esfera de radio unos 50 pm (Radio de Bohr, a0). Los
átomos de los demás elementos pueden tener prácticamente radios de unos 100 pm
(1 pm = 1x10-12 m).
Posee
un núcleo central (protón) y un electrón en una órbita circular o elíptica.
El premio Nobel de Física Niels Bohr propuso un modelo de átomo de hidrógeno con un núcleo central, en el que existe una
partícula cargada de electricidad llamada protón,
y girando en su entorno en una órbita
o capa otra partícula cargada, el electrón.
Si el núcleo del átomo de H fuese la Tierra, de radio unos 6 400 km, el
electrón giraría en una órbita de radio unos 320 millones de km; recuérdese que
el Sol se halla a unos 150 millones de km de la Tierra, luego quedaría dentro
del átomo.
El protón tiene
carga eléctrica elemental positiva, + 1,67.10-19 C, masa
de 1,673.10-27 kg (unidad de masa atómica, u,
equivalente a una energía de 938,3 MeV según la ecuación de Einstein m·c2;
unidad utilizada para el estudio de las partículas del átomo) y radio
aproximado de 1.10-15 m (1 fm o fentómetro). Es, por tanto,
unas 50 000 veces más pequeño que el radio del átomo. Su periodo o tiempo de
vida media es prácticamente infinito.
Alejados
a gran distancia del núcleo, comparada con las dimensiones del mismo átomo, se
hallan los electrones separados del núcleo nada más que por
el vacío. La masa del electrón es 9,1.10-31 kg (cerca de 2 000 veces menor que la
del protón, de tal manera que la masa del átomo reside prácticamente en el
núcleo y es la suma de la de los protones y los neutrones). Los electrones
están atraídos eléctricamente por el núcleo, con igual carga eléctrica y de
signo contrario (En un átomo hay tantos electrones como protones, de tal forma
que el átomo es una partícula material eléctricamente neutra, si no fuese así,
se trataría de un ion). La carga del electrón es -1,67x10-19 C, carga eléctrica elemental.
Como
hemos indicado antes, los demás elementos químicos poseen átomos con más de un
electrón girando en torno a núcleos con varios protones y con otro tipo de
partículas, los neutrones de masa (1,675.10-27 kg equivalente a 939,6 MeV)
ligeramente superior a la de los protones y sin carga eléctrica. Poseen radio
igual al del protón: 1 fm. Fuera
del núcleo atómico, son inestables, teniendo una vida media de 15 minutos; un
neutrón se descompone en un electrón, un antineutrino y un protón.
1 1 0 0
n → p + e + /v
0 +1 -1 0
Reacción
de desintegración de un neutrón libre (1 u de masa y 0 de carga)
en
un protón (1 de masa y +1 unidad de carga), un electrón (prácticamente 0
de
masa y -1 de carga) y un
antineutrino (0 de masa y 0 de carga)
Los neutrones están sujetos con los protones en el núcleo atraídos
por fuerzas nucleares residuales provenientes de los quarks que los integran y que son las
verdaderas partículas elementales (realmente son las partículas llamadas
gluones las que mantienen unidos a los quarks y son las transmisoras de las
fuerzas fuertes que dan estabilidad al núcleo atómico). Los quarks, que forman
los neutrones y los protones, pueden ser de dos tipos: up (u) (arriba) y
down (d) (abajo).
El modelo
de átomo del sistema planetario de órbitas explica muy elementalmente cómo es
el átomo. Según el modelo actual de la Mecánica
Cuántica, la posición del electrón no se puede determinar con exactitud,
pero sí se puede representar la probabilidad de encontrarlo en determinada región
alrededor del núcleo (orbital) y
entonces se puede simular el átomo mediante una esfera con nube difusa o de
puntos indicativos de la máxima probabilidad de presencia del electrón en
cierta región alrededor del núcleo central (modelo de la nube
electrónica). En el átomo de hidrógeno, el orbital posee una determinada
energía (nivel de energía que, por cierto, se corresponde con la órbita de
Bohr) y encierra el 99,99% de probabilidad de presencia del electrón (en el
átomo de hidrógeno, la probabilidad de encontrar el electrón es máxima en una
superficie esférica cuyo radio coincide prácticamente con el Radio de
Bohr, a0).
-Átomo de hidrógeno. Posee un orbital (de símbolo s) en el que se
halla la carga eléctrica de un electrón en la primera capa o nivel de menor
energía (estructura 1s1).
-Átomo de
helio. Con dos electrones en el primer orbital (1s2).
-Átomo de
litio. Con dos electrones en el orbital atómico s y uno en el segundo nivel
(estructura 1s22s1)
La estructura o configuración electrónica del átomo de Be, que
posee cuatro electrones, es 1s22s2. El de B que
posee cinco, es 1s22s22p1. El de C, con seis
electrones, tiene la configuración 1s22s22p2 y así se continúa con los átomos de
los elementos siguientes en la tabla periódica hasta completar, caso
del Ne, el orbital p de la segunda capa con seis electrones (1s22s22p6).
A partir de ahí se va completando la tercera capa de forma similar, hasta que
en la cuarta capa se completa el orbital d, con diez electrones. Una vez en la
quinta y en la sexta capa
comienzan a llenarse otro tipo de orbitales f. Así se completa la estructura
electrónica siguiendo el orden creciente de energía de los orbitales.
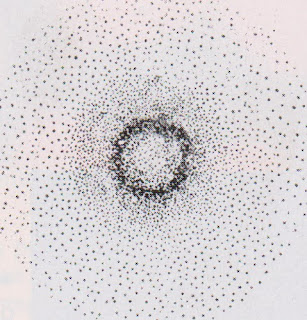
Actualmente se han encontrado imágenes del H
Similares a la del modelo de la nube electrónica.
El número de protones que tiene el núcleo de un átomo es el
llamado número atómico, Z,
característico de cada elemento químico (a diferencia del número másico, A, o número de nucleones que posee (p
+ n) . Es decir, dos elementos se distinguen por su número atómico, por
ejemplo, el H tiene de número atómico Z = 1 y el carbono Z = 6, pues éste posee
seis protones en su núcleo atómico (y por supuesto seis electrones alrededor).
A y Z son pues dos números enteros que
se sitúan a la izquierda, como superíndice y subíndice respectivamente, del
símbolo del elemento para expresar el núcleo de un átomo:
A
X
Z
Precisamente por el número atómico creciente se clasifican los
elementos químicos en la tabla
o sistema periódico, desde el elemento más sencillo, el H, hasta
completar los elementos naturales (con el de Z = 92, uranio, U) y
continuar con los artificiales (hasta, por ahora, el de Z = 118, ununoctio, de
símbolo Uuo).